El número de oxidación de los elementos ubicados en el Grupo IA (metales alcalinos), siempre es de +1.

El número de oxidación de un ion monoatómico es igual a la carga del ion, por ejemplo en el caso del ion Cloro Cl-1, su número de oxidación es de -1.


El número de oxidación de todo elemento en estado libre siempre es de cero.
REGLAS PARA ASIGNAR NÚMEROS DE OXIDACIÓN.
El número de oxidación de los metales siempre será positivo y el de los no metales y metaloides puede ser positivo o negativo.
El número de oxidación del oxígeno en todos sus compuestos de de -2. A excepción de los peróxidos donde el número de oxidación es de -1.


La suma de los números de oxidación en toda molécula debe dar cero, puesto que las moléculas son eléctricamente neutras.
El número de oxidación de los elementos del Grupo VIIA o Halógenos, al combinarse con un metal será igual a -1.
El número de oxidación de los elementos del grupo IIA (metales alcalinotérreos) es siempre de +2.


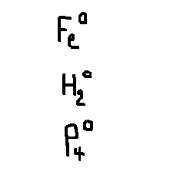
Evidencian la carga neta con la que quedan los átomos en una molécula, después de asignar los electrones de enlace al elemento más electronegativo.
El número de oxidación del hidrógeno en todos sus compuestos es de +1. A excepción de los hidruros.
Ejemplo en el compuesto conocido como cloruro de sodio NaCl el sodio tiene como número de oxidación igual a +1º y el cloro -1.

La suma de los números de oxidación de todos los átomos de un ion poliatómico es igual a la carga del ion.