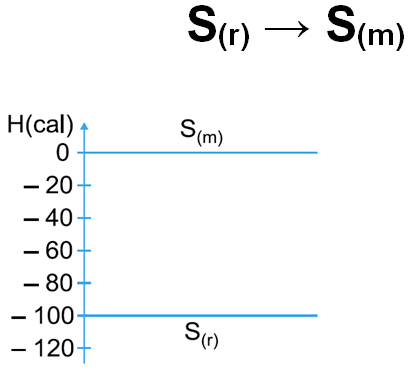
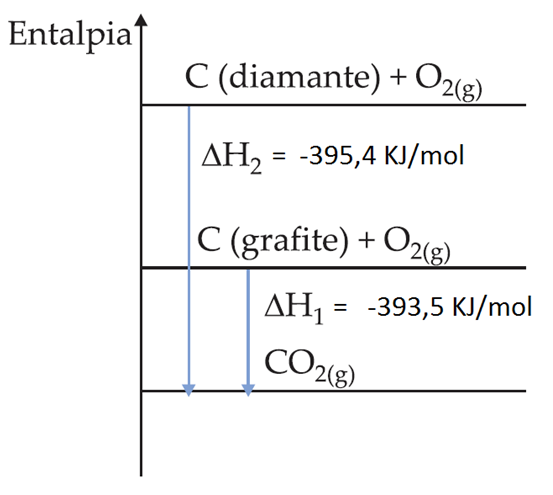
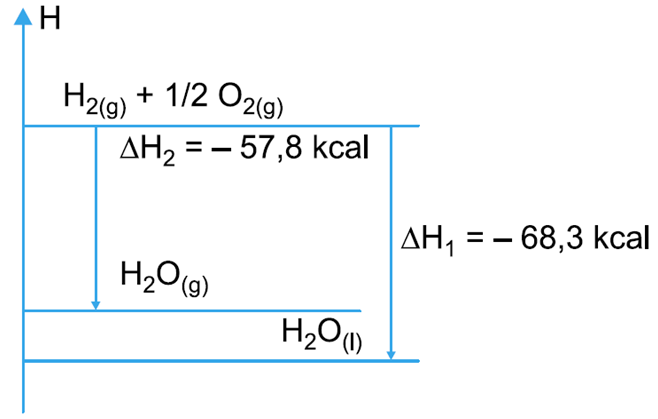
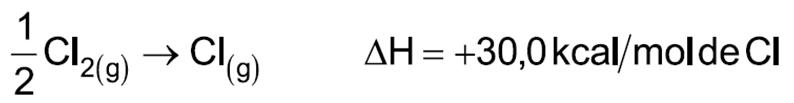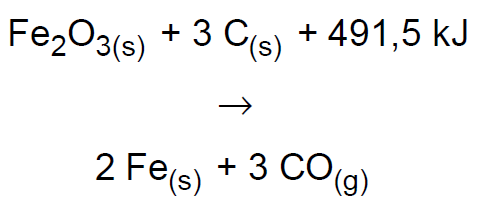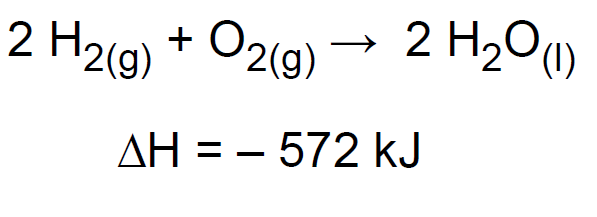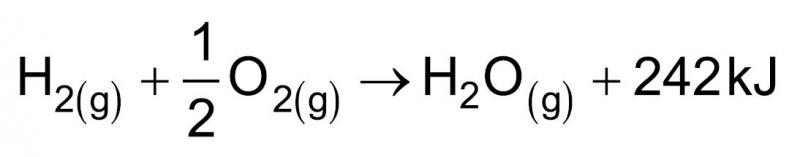13.
Quando 0,500 mol de etanol (C2H6O) líquido sofre combustão total sob pressão constante, produzindo CO2 e H2O, gasosos, a energia liberada é 148 kcal. Na combustão de 3,00 mols de etanol, nas mesmas condições, a entalpia dos produtos, em relação à dos reagentes, é: