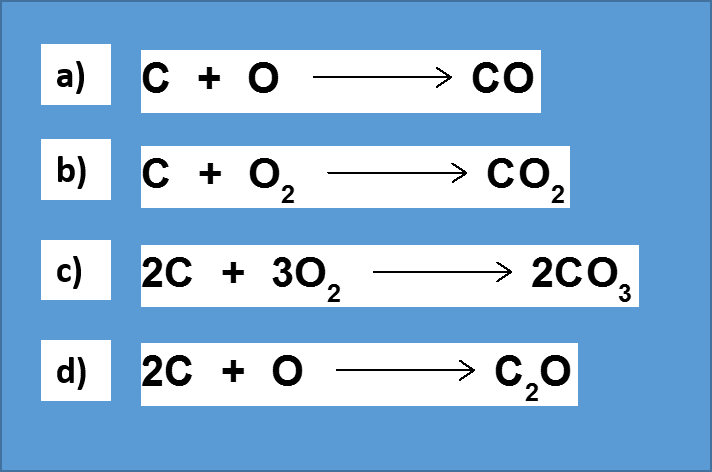
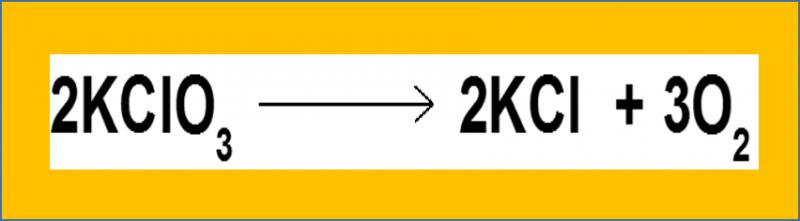
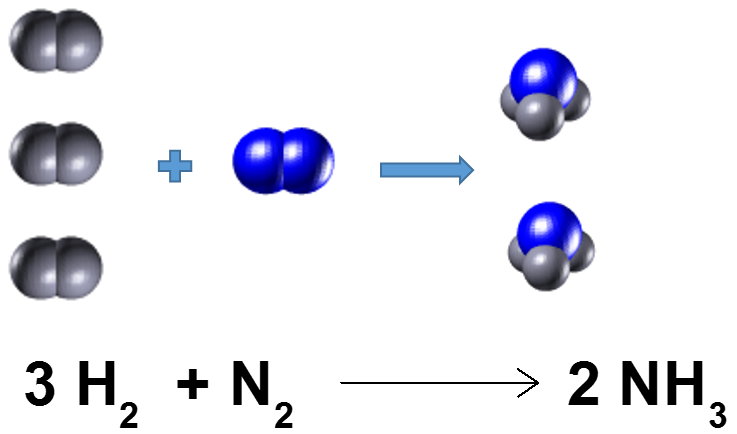
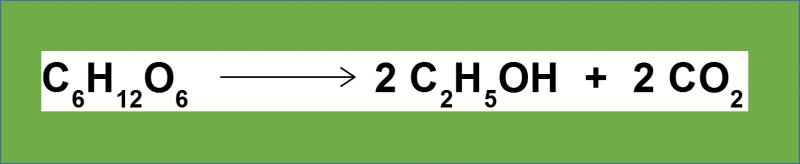
8.

El carburo de silicio, SiC, se conoce por el nombre común de carborundum. Esta sustancia de consistencia dura se utiliza comercialmente como abrasivo, se prepara calentando SiO2 y carbono a temperaturas elevadas, según la ecuación de la imagen. ¿Cuántos gramos de SiC se pueden formar si se hacen reaccionar 15.0 g de SiO2 y 20.0 g de C? Masas atómicas: Si=28.09, C=12.01 y O=16 uma.