7.
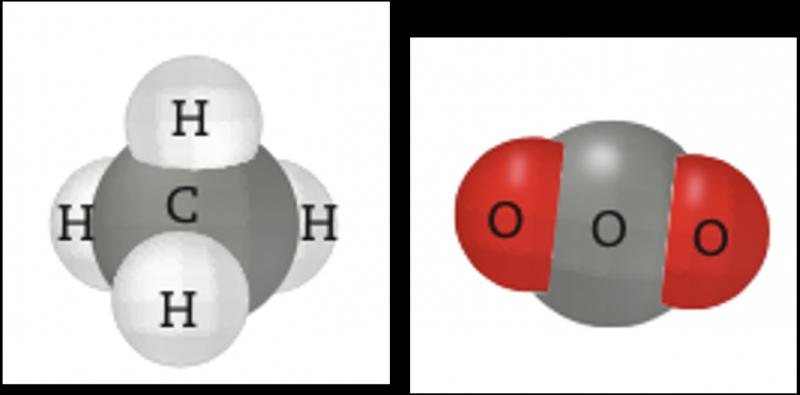
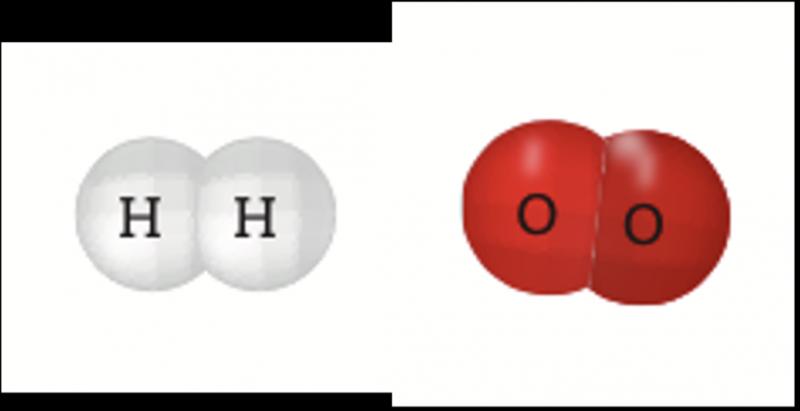
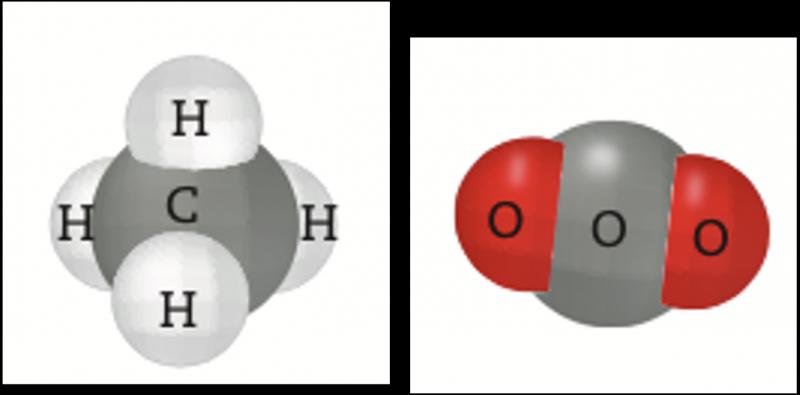
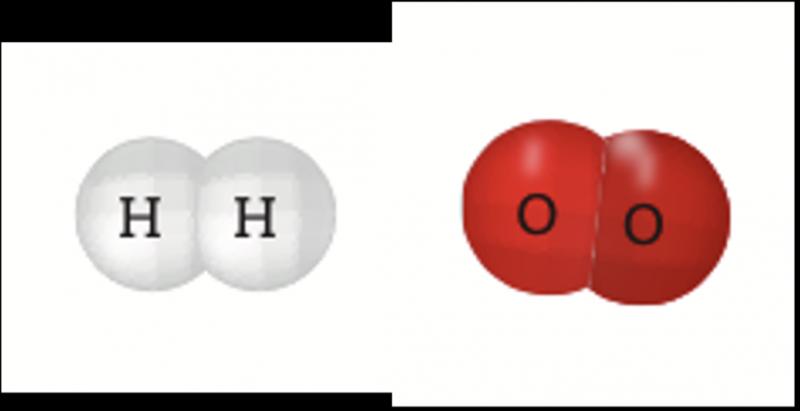
Las sustancias, ya sean elementos o compuestos, están formadas por átomos que tienen interacciones. Éstas se deben a la forma en que se distribuyen los núcleos y los electrones. Los electrones de los niveles más energéticos, o electrones de valencia, son los responsables de dichas interacciones y forman los