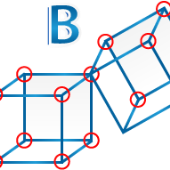
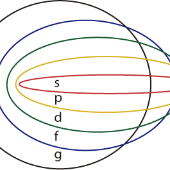
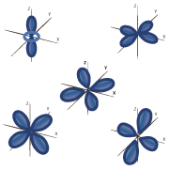
El modelo de Schrödinger integra el concepto de números cuánticos para describir un orbital e indica mediante representaciones las características relacionadas a: Nivel energético, subnivel energético (posición), Spin y momento angular.
En el S. XIX, el gran químico inglés, John Dalton, se basó en la hipótesis de Demócrito y pudo así establecer las bases de la teoría atómica, con el primer modelo atómico con bases científicas, postulando la Ley de las proporciones constantes para las reacciones químicas.
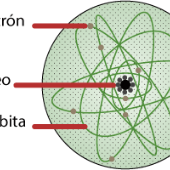
En 1913 Bohr explicó cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión, además de tomar ideas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
La materia se encuentra conformada por partículas idénticas e indivisibles, que no pueden ser divididas ni destruidas.
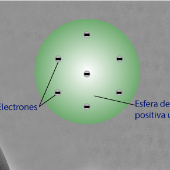
Thomson: Propuso la estructura atómica en 1904, además de realizar los postulados sobre la conformación y la idea del electrón. El átomo está compuesto por electrones de carga negativa en un átomo positivo.
Sommerfeld: Mejoro el modelo atómico de Bohr, introdujo algunas modificaciones básicas: orbitas casi-elípticas para los electrones, a partir del segundo nivel energético existen dos o mas subniveles en el mismo nivel y que el electrón es una corriente eléctrica minúscula.
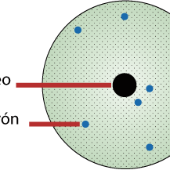
Se le debe un modelo atómico, con el que probó la existencia del núcleo atómico, en el que se reúne toda la carga positiva y casi toda la masa. En 1908 Rutherford fue merecedor del Premio Nobel de Química, por sus estudios sobre radiactividad.
Propuso la teoría sobre los enlaces químicos y la definición de ácido y base. En 1916 Lewis promulgó una teoría sobre determinados enlaces químicos denominados “enlaces covalentes”.