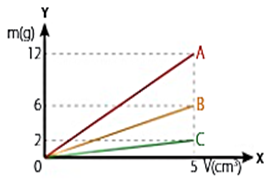
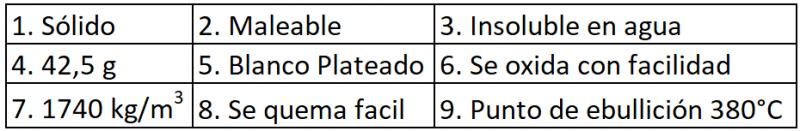
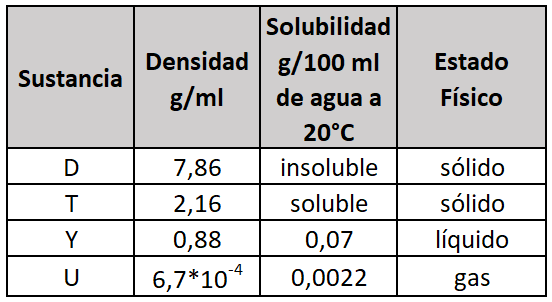
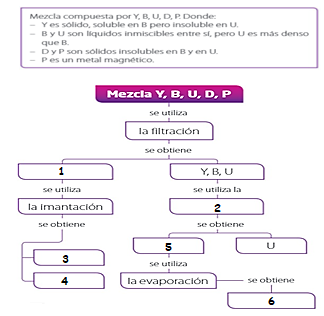
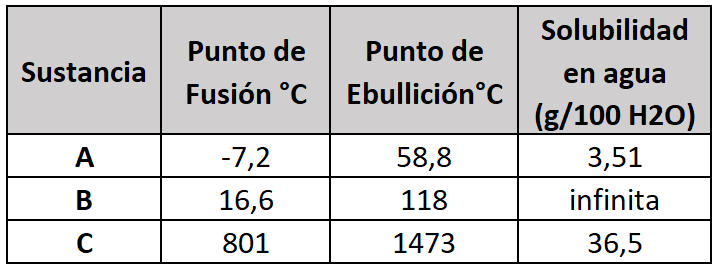
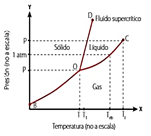
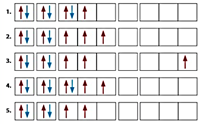
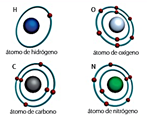
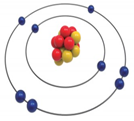
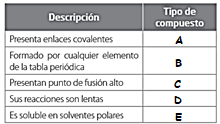
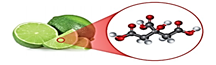
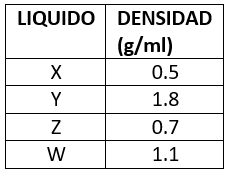
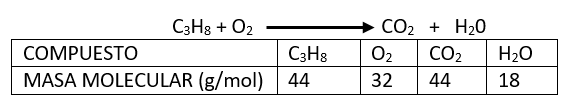
26.
La alucina es el compuesto responsable del olor característico del ajo. Un análisis del compuesto, determino que está formado con Carbono, Hidrogeno, Azufre, Oxigeno en relación 6:10:2:1. Pesos atómicos (C:12; H:1; S:32; o:16). Sabiendo que su masa molar es 162 g/mol, podemos afirmar que las formulas empírica y molecular son respectivamente: