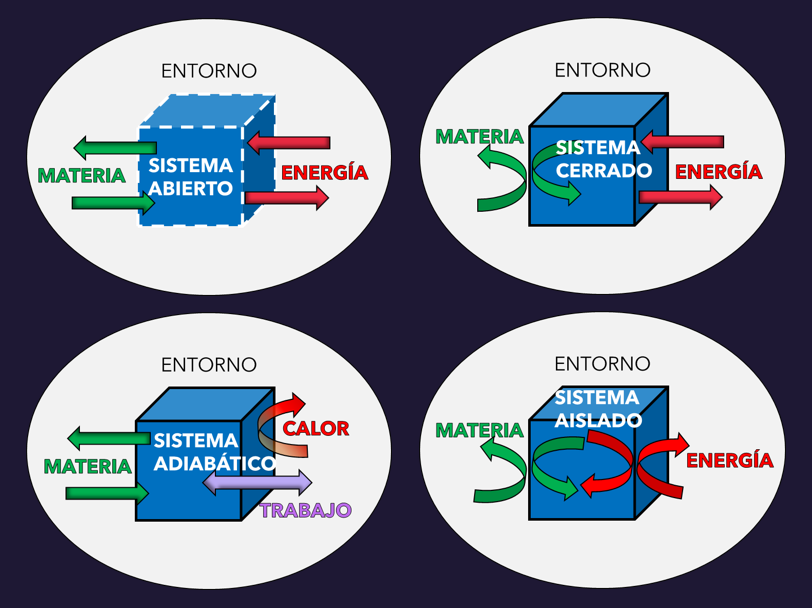
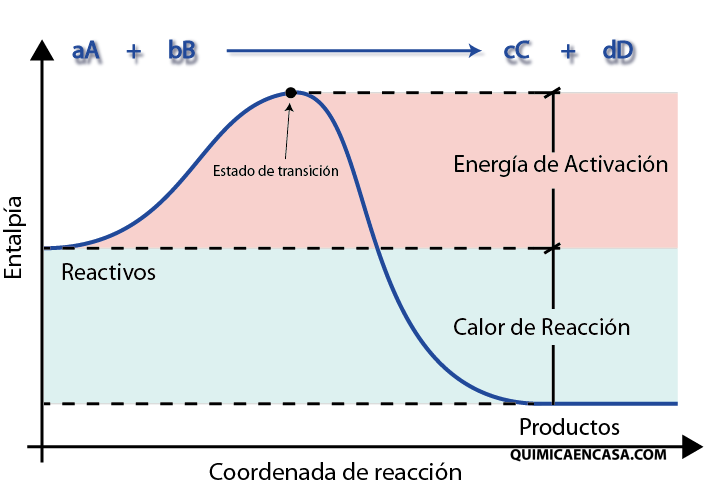
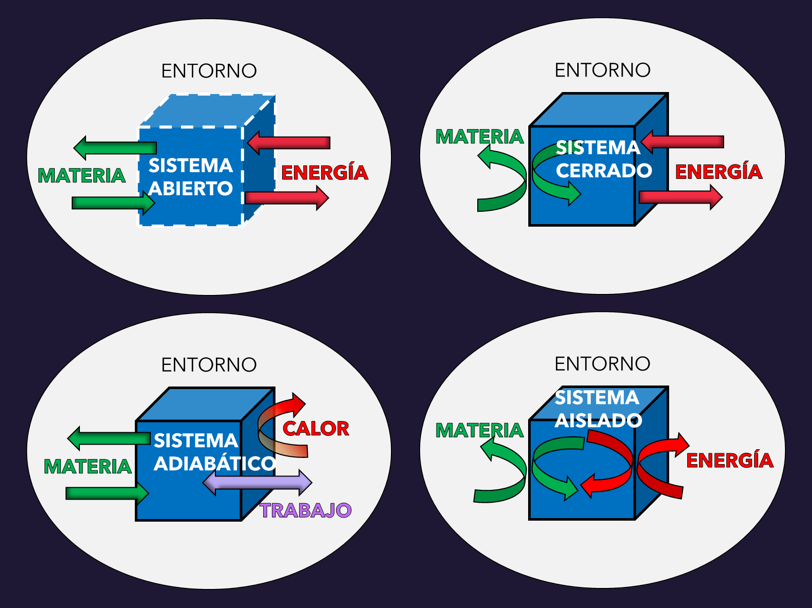
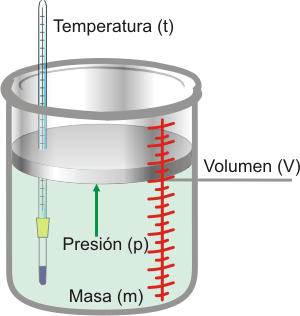
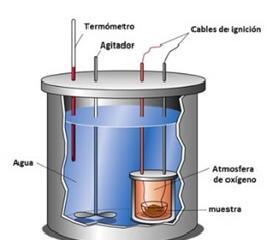
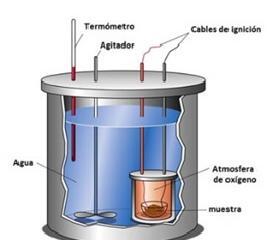
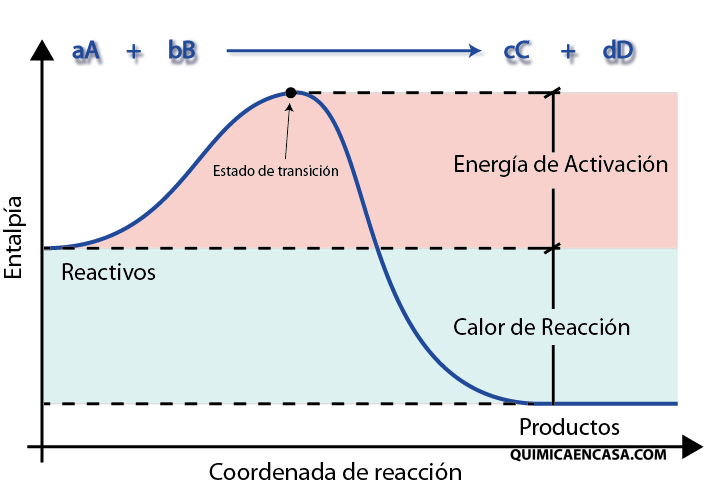
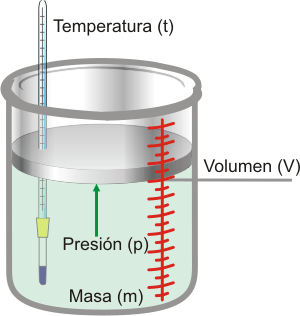
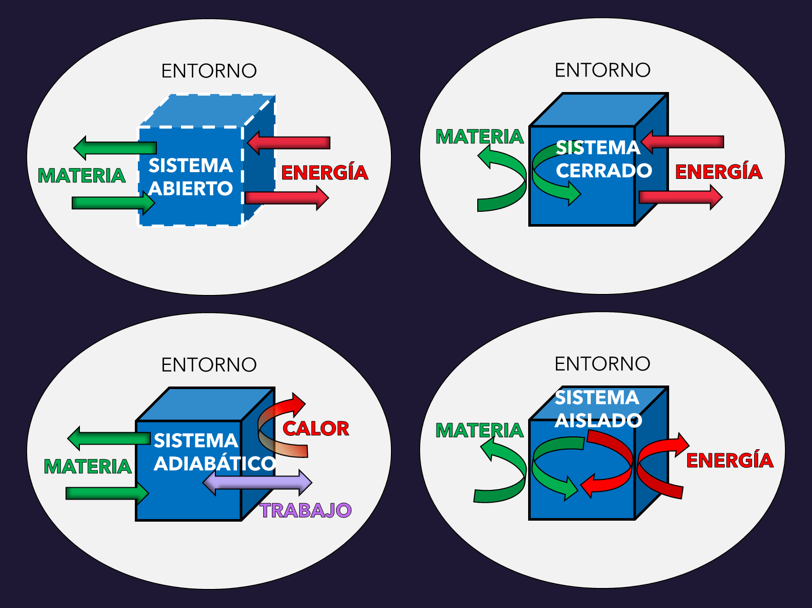
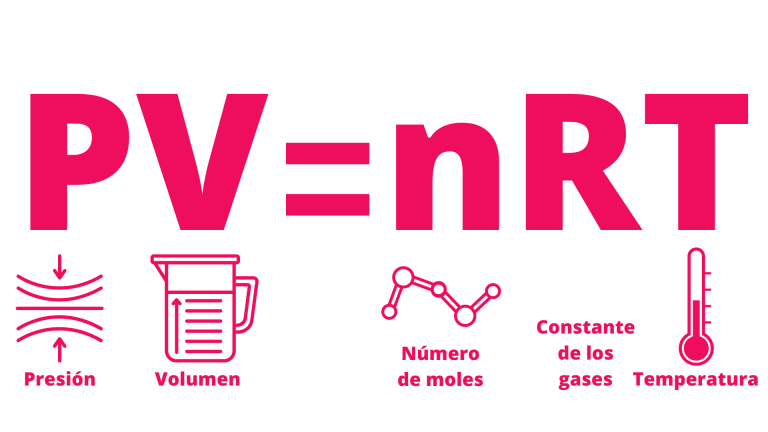
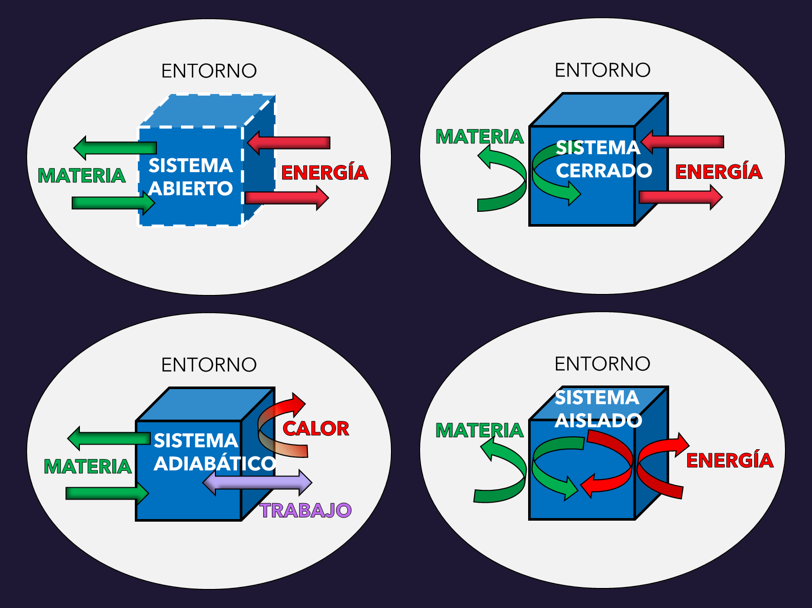
14.
En un laboratorio, a temperatura ambiente (25ºC), se introducen en un vaso de precipitado 100g de hielo a -2ºC y 150g de agua a 60ºC ¿Qué temperatura alcanzará la mezcla cuando se alcance el equilibrio térmico? (H₂O(l): Ce=4,18J/gºC; H2O(s): Ce=2,09 J/gºC y λf=333,5 J/g)